《破天机:基因编辑的惊人力量》 田牧歌解读
《破天机:基因编辑的惊人力量》| 田牧歌解读
关于作者
本书作者是世界生物化学界的顶级学者,美国生物化学家珍妮佛·杜德娜和塞缪尔·斯滕伯格。珍妮佛·杜德娜是美国加州大学伯克利分校的分子与细胞生物学系和化学系教授,她因为发明CRISPR基因编辑技术而斩获了2020年诺贝尔化学奖,塞缪尔·斯滕伯格是杜德娜的学生,也在发明这项技术的过程中贡献了重要力量。
关于本书
本书分为上下两篇,上篇介绍了CRISPR基因编辑技术的诞生过程和技术原理,下篇则主要讨论了作者对基因编辑技术未来应用的看法。通过围绕CRISPR基因编辑技术进行论述,作者向读者展示了生命的天机是如何被科学家们参破的,以及“破天机”对人类未来的重大意义。
核心内容
基因编辑其实就是按照人类意愿,对生物体内基因进行修改的一种技术。作者和她的团队基于细菌体内一段名为“CRISPR”的DNA序列,于2012年发明出了CRISPR基因编辑技术,这项技术让基因编辑的成功率提升到接近100%,成本大幅下降,让人类第一次真正拥有了参破天机的能力。不过也正因为CRISPR技术十分强大,其在植物、动物、人体细胞和人胚胎细胞上的应用,也引发了大量的社会和伦理问题。作者认为,目前基因编辑的应用需要十分慎重,但未来,这项技术将毫无疑问在各个领域造福人类。
你好,欢迎每天听本书,本期要为你解读的书是《破天机:基因编辑的惊人力量》。
我们都知道,基因是所有生物体内的一套遗传密码,它决定着生物的基本构造和性能,生、老、病、死等一切生命现象都和基因有关。基因的演化是自然选择的结果,是自然界不可泄露的“天机”,而人类掌握了基因编辑技术,就意味着“参破天机”,掌握了生命的终极规律。
基因编辑也被称为“上帝的手术刀”。那么,这本书的作者是什么人呢?他们正是那个从上帝手中成功夺取了“手术刀”的人。
两位作者珍妮佛·杜德娜和塞缪尔·斯滕伯格,都是美国的生物化学家。杜德娜是2020年的诺贝尔化学奖得主,现为美国加州大学伯克利分校的教授,她的获奖理由是发明了CRISPR基因编辑技术,这是目前世界上最先进的基因编辑技术,这项技术的诞生让基因编辑第一次有了广泛应用的可能性。斯滕伯格是她的学生,也在发明这项技术的过程中贡献了重要力量。
基因编辑领域,因为CRISPR技术的发明,而实现了飞跃式的进步。何以见得?在上世纪80年代,编辑单个基因的成功率能达到1%,就已经很了不起;到21世纪初,编辑单个基因的成功率提升到接近10%;而CRISPR技术的诞生和完善,直接让基因编辑的成功率提升到接近100%,而且,不再局限于对单个基因的编辑,复杂的多基因同步编辑也成为现实。
也正是在CRISPR技术的帮助下,科学家们制造出了抗病水稻、晚熟番茄、毒素含量更少的土豆、像猫一样小的迷你猪,还有肌肉特别发达的警犬等转基因生物。一个个原来难以想象的突破,随着这项技术的诞生轻松变成了现实。它成为科学家们手中最强大的基因编辑工具,被称为基因操作的“圣杯”。
当然,因为基因编辑的力量实在太过巨大,所以,这项技术也面临着复杂的科学和伦理问题。比如,转基因农作物是否安全?基因治疗动物是否会带来不可挽回的副作用?基因治疗是否可以应用于人体?还有,是否可以对人类胚胎细胞进行编辑?等等。针对这些问题,近些年在社会上已经有相当多的讨论。
在这本书里,作者为我们还原了CRISPR基因编辑技术诞生的全过程,并谈到他们关于基因编辑伦理和未来应用的看法。作者的论述条理清晰,充满思辨性,为我们客观认识基因编辑这项伟大的技术,提供了非常有价值的参考。接下来,我就分成两个部分,来为你解读这本书。
我们先来说说,基因编辑的原理和意义到底是怎么回事?CRISPR技术又是如何诞生的?
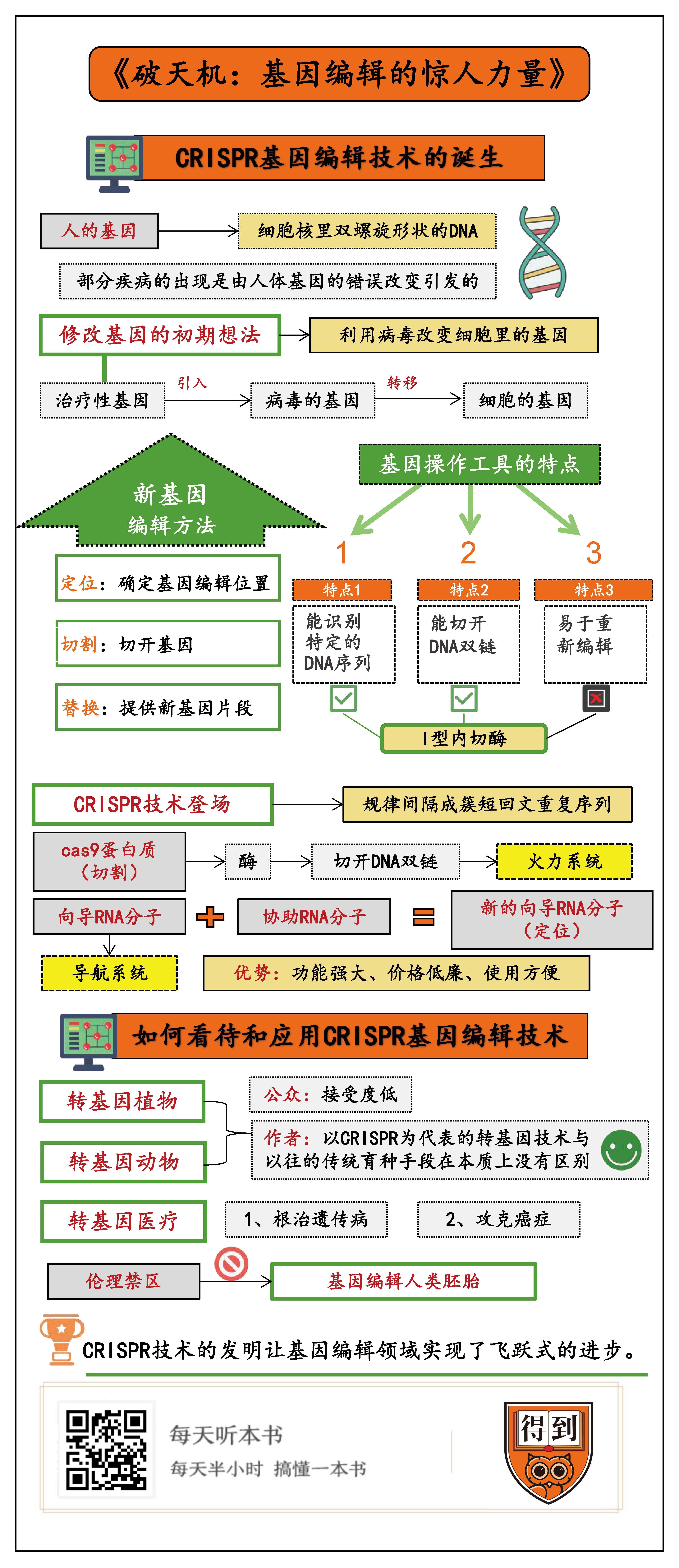
要回答这两个问题,我们首先得知道,人类很多疾病的出现,并不是身体的某个部位受了损伤,而是细胞里的基因出了问题。比如,有一种叫WHIM综合征的罕见遗传病,它的起因就是人的基因里出现了一处小错误,这个错误有多小呢?
人的基因是细胞核里双螺旋形状的DNA,DNA的基本组成单位是4种脱氧核糖核酸分子,这四种分子因为其中一个叫“碱基”的组成部分有所不同,在生物学里分别用英文字母A、G、T、C表示,每两个脱氧核糖核酸通过碱基配对形成一对,左右相互延伸就成了DNA双螺旋长链。人体内的基因,有大约32亿个碱基对,而WHIM综合征,就是因为其中1个碱基对发生了错误变异,导致患者特别容易被“人乳头瘤病毒”(也就是我们平常说的HPV病毒)感染,最终患上癌症。当然,除了WHIM综合征,还有其他大量疾病,比如镰刀型细胞贫血症、乙型地中海贫血症等,都是由人体基因的错误改变引发的。
治病要对症下药,要想根治这些疾病,很显然也需要从基因层面入手,修复患者体内的错误基因,这就是人们对基因编辑的最迫切需求。可是,问题来了,我们该怎么修改基因呢?细胞本来就无比微小,基因又只是细胞里的一系列分子,显然,我们不可能在宏观层面对基因进行任何操作。微观问题只能用微观手段来解决,科学家们为此做了很多尝试。
科学家们想到的第一个办法是利用病毒。我们都知道,病毒不能独立生存,只能寄生在细胞里才能生存和繁衍,具体方式就是病毒先进入宿主的细胞,然后通过巧妙的手段,把自己的DNA注射进入宿主的DNA,借助细胞完成自己的生命活动。病毒在亿万年的时间里,早就摸透了细胞的各种弱点,非常擅长这套把戏。所以,在20世纪70年代,科学家们就开始尝试通过病毒来改变细胞里的基因,把治疗性的基因先引入到病毒的基因,再借助病毒之手,转移到细胞的基因里。
这种方法确实成功过,但问题也有很多,比如,病毒可能会引发严重的免疫反应,而且病毒把新的基因片段插到哪儿,也很难控制。插到不同位置,可能会有完全不同的效果,所以这种盲目的基因编辑,在实际应用中有很大的风险和局限。这就要求科学家们寻找新的基因编辑方法。
经过不断摸索,科学家们逐渐找到一个可行的思路,那就是先确定要在基因的哪个位置进行编辑,然后在这个位置上先把基因给切开,再提供需要替换的新基因片段。在这种情况下,细胞就会自动把新旧片段连接在一起,这样我们就能控制基因编辑的具体位置了。
为了做到这一点,科学家们需要发明一种基因操作工具,这套工具必须具备三个特点:第一是它要能识别特定的DNA序列,第二是能切开DNA双链,第三是它必须易于重新编辑,以便在不同的任务中识别不同的DNA序列。
在寻找这套工具的过程中,科学家们首先盯上了一种Ⅰ型内切酶,这种酶的效果很不错,它能切开DNA双链,而且,只有在准确识别18个连续的DNA碱基之后,才会开始剪切。这有点类似于特工执行任务前,需要先核对暗号。这个暗号的长度非常重要,它不能太简单,比如,如果内切酶识别的碱基数量只有6个,那么,人体基因里的32亿个碱基对,可能就存在着几十万个对应的剪切点,那就必然出错。而Ⅰ型内切酶让定位的精准度大大提高,所以,它确实有潜力成为一种优秀的基因编辑工具。
但紧接着,问题又来了。科学家们发现,Ⅰ型内切酶虽然能识别特定的DNA序列,也能切开DNA双链,但它无法重新编辑,也就是不满足基因操作工具的第三个必备特点。也就是说,这个“特工”的暗号只能有一个,不能随着任务的改变而改变,这就大大限制了它的应用场景。正当学界寻找其他替代工具时,作者的CRISPR技术登场了。
因为一次工作中的机缘巧合,作者从其他学者那里了解到CRISPR,这是一组英文单词的缩写,直译过来是“规律间隔成簇短回文重复序列”。听起来很绕口,不过不要紧,我们也不需要知道这个词的具体含义。简单来说,CRISPR是科学家们在细菌的基因里发现的一段DNA序列,这个序列很长,由很多重复片段和间隔片段组成。它就像一串由玛瑙和红宝石串起来的项链,每个红宝石是完全一样的,而玛瑙的花纹则各不相同。在这段序列里,也有很多完全一样的重复片段,这些重复片段中间,夹着长度相似但序列不同的间隔片段。
经过研究发现,那些不同的间隔片段,竟然和很多病毒的DNA片段完全吻合。而且,那些拥有CRISPR序列的细菌,和病毒匹配的片段越多,它们被病毒感染的概率就越小。这就暗示,CRISPR序列很可能和细菌抵抗病毒的入侵有关。后来科学家们果然证明,在病毒入侵细菌之后,细菌体内的CRISPR序列就会开始运转,制造出一条条和病毒DNA配对的RNA(也就是核糖核酸)短链。这些RNA短链,能靶向锁定病毒的DNA分子,并在切割酶的配合下,把它们切成碎片,这样就完成了自我防御。
这个过程听起来是不是很奇妙?CRISPR序列的作用原理,简单概括就是,病毒要想入侵细菌,就要把自己的DNA分子注射到细菌体内,然后自我复制,而细菌为了对抗这一过程,就在自己的DNA分子里,记下病毒DNA分子的样子,然后按图索骥,在遭到入侵时锁定入侵者的DNA,然后把这些DNA破坏掉。而且更强大的是,CRISPR序列还拥有记忆学习功能,当新型病毒入侵细菌之后,细菌会记录下新的入侵者的DNA序列,添加到CRISPR序列里,这样下次面对这类病毒,也就有了对抗能力。
同时,科学家还发现,只要细菌基因里有CRISPR序列,附近就一定会有另一个基因,这个基因被称作cas基因。实验证明,cas基因编码出的一系列蛋白质,和CRISPR序列的功能有密切关系,其中比较重要的是cas9蛋白质。
这个蛋白质实际上是一种酶,它的主要功能是切开DNA双链。作者的团队发现,cas9蛋白质要想发挥功能,需要和两种RNA分子密切配合,分别是CRISPR序列转录出的向导RNA分子,和另外一种协助RNA分子。具体工作原理其实很简单,首先,CRISPR转录出的向导RNA分子会根据自己的特定序列,靶向锁定DNA上的特定位置,然后在协助RNA分子的作用下,cas9蛋白质会和向导RNA分子结合,把这个特定位置的DNA双链切断。
在这个过程中,向导RNA有点像导航系统,精确制导到要进行基因编辑的DNA位置,而cas9蛋白质则是火力系统,负责对DNA进行精确打击,协助RNA分子则负责把这两个系统连接在一起。而且,相比于Ⅰ型内切酶,这个系统的优势非常明显,那就是科学家们可以很轻松地编辑向导RNA分子的序列,这样一来,这套系统就能指哪儿打哪儿,让科学家们随心所欲地在需要的位置把基因切开。
在发现这个机制之后,为了更方便地应用,作者的团队又开动脑筋,巧妙地把向导RNA分子和协助RNA分子连接起来,形成了一种新的向导RNA分子,由它负责定位,cas9蛋白质负责切割,简单高效。作者把这种基因编辑工具命名为CRISPR-Cas9基因编辑技术,简称CRISPR技术。
2012年这项技术诞生之后,迅速在基因编辑领域引起巨大轰动,因为它功能强大,价格低廉,使用方便,让基因编辑的可行性大大提升。在此之前,基因编辑工具设计复杂,成功率很低,而且价格昂贵,所以很难推广使用。但CRISPR技术可以很轻松地设计出便利的基因编辑工具,整个过程只需要几天时间,而且不需要额外培训。过去需要多年实验室训练才能完成的工作,如今只要一个高中生就能胜任了。有专家推测,现在建立一个CRISPR基因编辑实验室,只需要花不到2000美元。这一次,基因编辑的大门,真正地向人类敞开了。
了解了CRISPR基因编辑技术的诞生经过,现在你应该知道基因编辑的影响到底有多深远了,但科学总是一把双刃剑,既有创造力,也有破坏力。所以,接下来我们就聊聊,为了更好地造福人类,我们该如何看待和应用基因编辑技术?
基因编辑技术让人类有能力按照自己的意志,改写任何生物的基因。但是,问题也随之而来,有关于植物和动物的,也有关于人类的。我们先说说转基因植物和动物。
这些年,转基因作物的话题一直有很高的社会关注度,人们制造转基因作物的初衷是好的,比如抗击病虫害,提高农作物产量,更好地满足人类的农产品需求。事实也确实如此,比如,科学家们陆续制造出了免疫白粉病的小麦、反式脂肪酸含量更低的大豆,还有能抵抗棉铃虫的棉花,等等。这些转基因作物性能优异,一经推出就很快占领市场。截至2015年,美国92%的玉米和94%的大豆,都是转基因作物。
不过,虽然优势明显,每年都有数以亿计的人吃下转基因作物,而且没出现过什么问题,但转基因作物的安全性仍然饱受质疑,比如有调查显示,60%的美国人认为转基因作物不安全。
而且,相比于转基因植物,公众对转基因动物的接受程度更低。比如,在美国获准上市的第一种转基因动物,是一种转基因三文鱼,这种三文鱼在被基因编辑之后,分泌的生长激素更多,生长周期只有原来的一半,而且营养成分也完全相同,但即便如此,转基因三文鱼还是受到严厉抵制,有人把它称为“怪兽鱼”。根据《纽约时报》的调查,有75%的受访人员表示拒绝食用这种转基因鱼。虽然现在科学家们已经制造出了瘦肉含量更高的转基因猪,羊毛长度更长的转基因山羊,但可以想象,这些转基因动物的社会接受度都不会很高。
那么,作为基因领域的顶尖科学家,本书的作者是如何看待转基因植物和动物的呢?她认为,实际上,几乎我们吃的每种食物,它们的基因型都被人为改造过,比如,选育种子和配种时用的随机诱变技术和杂交技术,本质上都是在按照人类需求改变动植物的基因型。从这个意义上说,以CRISPR为代表的转基因技术,和以往的传统育种手段,在本质上没有什么区别。
所以,作者对转基因植物和动物的未来应用,抱有乐观的态度。她认为,未来人类肯定还需要解决很多问题,来确保基因编辑技术应用在动植物身上的绝对安全,但人们肯定有智慧去解决这些问题。很显然,今天我们对转基因动植物安全性的争论不会轻易停止,但未来,它们造福人类的历史趋势是很明显的。
作者还举了一个例子,其实转基因动物不仅能给人类提供肉类和皮毛,甚至还有希望拯救很多人的生命。比如在美国,现在有大约12.4万人在等待器官移植,但每年只有2.8万人能获得移植器官,大量病人在等待器官的过程中死去,缺乏器官供体是一个很现实的问题。科学家们设想,通过基因编辑技术,人类或许可以改造猪的基因,让猪生长出可以供人类使用的器官。而且,这项技术目前已经有了初步成果,科学家们把经过基因改造的猪作为移植器官的供体,一颗移植肾脏在狒狒体内维持了6个月,一颗移植心脏在另一只狒狒体内维持了2年半。目前,这个领域已经吸引了大量投资。所以,如果基因编辑技术真的能拯救人类的生命,提供宝贵的移植器官,那我们真的很难拒绝它。
说到这里,我们就不得不开始一个更敏感的讨论,那就是该如何看待基因编辑技术在人体上的应用呢?
基因编辑应用于人体,最直接的方式是治病。举例来说,最有希望通过CRISPR疗法根治的一种遗传病是乙型地中海贫血症,这种疾病虽然能通过骨髓移植根治,但患者一般很难找到配型吻合而且愿意捐献骨髓的供体,而基因编辑就能解决这个问题。医生只要从患者体内分离出干细胞,利用CRISPR技术修复干细胞中的乙型球蛋白基因,然后把编辑过基因的细胞输回患者体内,患者就能分化出正常的血红细胞,而且,因为供体和受体都是自己,患者在整个过程都不会出现免疫排斥问题,这就为很多人带来了生命的希望。
除了遗传病,基因编辑技术还可能帮助我们攻克癌症。一个思路是,为了消灭体内的癌细胞,我们可以通过基因编辑,制造出一种特殊的T细胞,这种新型T细胞里引入了一种新的基因,它可以帮助T细胞识别、靶向锁定最终消灭癌细胞,从而治疗人的癌症。这项技术目前还在探索之中,不过,2015年就有科研机构在一名女婴身上使用过这项技术,通过向女婴体内输入经过基因编辑的T细胞,成功让女婴的白血病得到好转。
可以说,基因编辑在医学领域有着巨大的使用潜力,但我们也要清醒地认识到,这项技术离成熟应用还有很长的距离。比如,基因编辑的准确性并不能达到100%,一旦失败,潜在的风险很大。
在CRISPR技术中,向导RNA能识别20个碱基长度的特定DNA片段,但科学家们发现,这种识别不是绝对准确的,如果一个相似的片段只有一两个碱基不同,CRISPR很可能就会错误识别,进行错误的切割,这种现象被称为脱靶效应。一般来说,脱靶效应是一个很普遍的医学现象,比如看看各种药品的说明书,基本上都会标注副作用。但基因编辑的脱靶效应格外危险,毕竟普通药物的副作用在停药后就会结束,但基因编辑一旦脱靶,对基因造成的改变就永远无法挽回了。
除了脱靶效应,人类对各个基因的作用和影响,了解得也很有限。很多疾病的成因非常复杂,可能是遗传变异和环境因素的综合产物,单纯编辑基因不一定有效果。更何况基因编辑还存在次级效应,可能带来很多意想不到的复杂后果。比如,修改人体的CCR5基因,理论上会增强人对艾滋病的抵抗力,但同时也会增加人患上西尼罗河病的风险;虽然有的基因会增加人患上阿尔茨海默病的风险,但研究显示,这些基因也会提高人在年轻时的认知能力。面对基因编辑的复杂后果,该如何进行取舍?如何判断风险?仍然需要社会各界进行深入思考。
让我们再进一步。如果说基因编辑应用在医疗方面,还能被大多数人接受的话,那么,将它应用在人类胚胎上,试图去修改人类后代的基因型,则还处在伦理的禁区。实际上,科学家们已经编辑了大量其他生物的胚胎基因,所以基因编辑人体胚胎,在技术上其实已经不存在问题了。正如我们都知道的,南方科技大学原副教授贺建奎,就是因为违规对人体胚胎进行了基因编辑,诞下了两名女婴,引发了社会各界的严厉批评和反对,他本人也因此获刑入狱。
目前,社会各界都一致同意禁止基因编辑人类胚胎细胞,主要是因为还有大量伦理问题没有被解决。首先,如果我们真的对人类胚胎细胞进行基因编辑,那么,人们肯定就不满足于仅仅把有害的基因改变成正常基因,而会进一步想把它变成更优秀的基因。所以,不管一开始人与人之间的基因差距有多小,能负担得起基因改造的富裕阶层,肯定会让自己的后代拥有更优秀的基因,这不可避免地会带来阶层固化和基因固化,未来的有钱人会活得更长,体能更好,大脑更聪明。如果这种改变持续的时间足够长,那富人和穷人还是同一种生物吗?这会带来严重的、不可逾越的社会不公。
再比如某些基因改造,会让人体内的红细胞生成素含量上升,大大提高运动员的耐力值;还有的基因改造会减少人的睡眠时间,变相增加可以参与劳动的时间。如果这些改变真的出现,体育竞技是否还有公平可言?不进行基因改造的人,还有没有社会竞争力?少数基因群体会不会受到歧视?人类生理和文化的多元化,又是否会受到挑战呢?所以,作者认为,目前任何人都不应该进行人类胚胎细胞的基因编辑,除非各种社会、伦理和哲学问题得到深入讨论,并且在全球范围内取得共识。
但是,作者也提出了她的观点,那就是在未来,基因编辑人类胚胎细胞是肯定会发生的,问题只在于何时发生,还有如何发生。一方面,基因编辑的成功率会随着技术的改进不断提升,迟早会达到100%的准确率,这就能避免技术上的风险;另一方面,我们每个人在生命之初,其实都会携带从父母生殖细胞中继承的50-100个基因突变,而且在人体内,平均每秒钟都会出现上百万个突变,所以人体基因的改变其实是一种常见的自然现象,基因编辑只是让这种改变有了方向性。所以她认为,未来的父母有权利使用CRISPR技术来生出更健康的孩子,只要这个过程是安全的,而且不偏袒少数群体。
科学家们面对这个问题,早已展开了各种讨论,作者就亲自组织过多场论坛,与社会各界交换了基因编辑用于人类的意见。能力越大,责任就越大,面对修改生命密码的伟大工具,付诸行动前的慎重思考,是必须的。
好,我们来总结一下本期音频的内容。
第一部分,我们讨论了CRISPR基因编辑技术是如何诞生的。为了按照我们的意图修改生物的基因,科学家们尝试了多种路径,最终由作者所在的团队于2012年开发出了CRISPR基因编辑技术,这项技术让科学家们能以非常简单廉价的方式,对生物的DNA进行编辑和修改。
第二部分,我们讨论了该如何看待和应用基因编辑技术。基因编辑的力量相当强大,但也带来了很多社会伦理问题。不管是转基因农作物、转基因动物,还是转基因医疗,在发展中都伴随着大量质疑,而基因编辑人类胚胎目前更是伦理的禁区。不过作者还是认为,未来转基因技术肯定会更好地为人类服务。
最后,我想分享书中的一个比喻。作者说,科学家们有点像一个喜欢拆玩具的大男孩,他很聪明,知道怎么拆开手表,甚至还可以完好地装回去,但如果他试着改进这块手表,比如为了方便看时间,他把指针变得更大一些,就可能让手表越走越慢,甚至干脆不走了,任何他以为是改进手表的努力,都可能起到反作用。同理,在过去几十亿年里,大自然一直都在对生物的基因组进行优化,我们没有理由觉得,自己刚发现生命的奥秘,就能比大自然做得更好。
我们对基因各有各的看法,就好比对转基因作物,有人爱,也有人恨。但可以肯定的是,未来基因编辑技术肯定会在更深层次上造福人类,但在此之前,还是让子弹多飞一会儿,仔细分析,充分讨论,避免潜在的风险。不过,正如作者所相信的,人类拥有做出正确决定的智慧。
撰稿:田牧歌转述:徐惟杰脑图:刘艳导图工坊
划重点
1.基因操作工具必须具备三个特点:第一是它要能识别特定的DNA序列,第二是能切开DNA双链,第三是它必须易于重新编辑,以便在不同的任务中识别不同的DNA序列。
2.如果允许改造人类的基因,那么不管一开始人与人之间的基因差距有多小,能负担得起基因改造的富裕阶层,肯定会让自己的后代拥有更优秀的基因,这不可避免地会带来阶层固化和基因固化,未来的有钱人会活得更长,体能更好,大脑更聪明。